Panel mixt alergeni (respiratori si alimentari)
Noul centru de recoltare Ploieşti Malu Roşu
Pe 8 august Synevo a deschis cel de-al 67-lea centru de recoltare din România şi al doilea din Ploieşti.
67-lea centru de recoltare din România şi al doilea din Ploieşti.
Adresa: Str. Malu Roșu, nr. 91A, bl. 101D1, parter, Ploiești
Tel: 021 9666
Program de lucru: L-V: 7.00 – 16.00
Program de recoltare: L-V: 7.00 – 14.00
Program recoltare probe ginecologice şi PAP: L-V: 7.00 – 14.00
Mai multe detalii AICI.
HIV – 1 ARN (CANTITATIV): 157 lei

Testul de detecție a HIV – 1 ARN (CANTITATIV) este necesar pentru monitorizarea evoluției bolii, diagnosticarea infecției la nou-născuți din mame seropozitive și evaluarea eficacității diferitelor tratamente antivirale.
Aproximativ jumătate dintre pacienții infectați acut cu HIV prezintă un sindrom pasager asemănător mononucleozei infecțioase; în fază acută nivelurile de HIV-ARN sunt crescute în timp ce anticorpii specifici pot fi încă nedetectabili. Din acest motiv, detectarea prin reacția de polimerizare în lanț (PCR) a acizilor nucleici HIV-1 s-a dovedit a fi mai sensibilă decât testele ELISA de generația a 3-a în perioada de „fereastra imunologică” (în primele 3-4 săptămâni de la contactul infectant).
Folosirea testelor de generația a 4-a care combină detecția anticorpilor HIV cu cea a antigenului p24 conduce la o sensibilitate clinică mai mare în faza precoce de seroconversie; totuși detectarea HIV1-ARN este posibilă cu 6 zile mai devreme în comparație cu cea a antigenului p24.
Pătrunderea HIV în organism se face la nivelul:
- mucoaselor urogenitale, rectale sau orale, prin contact hetero- sau homosexual;
- perinatal, de la mamă la făt;
- parenteral, prin soluții de continuitate ale tegumentelor și mucoaselor, injecții, tatuaje, transfuzii și transplant de organe de la donatori infectați.
Avantajele testului:
- sensibilitate și specificitate comparabile cu izolarea virusului;
- utilizarea unor cantități mici de probe de testat;
- testul este rapid și se observă un paralelism cert între încărcătura virală plasmatică sau celulară, depleția de celule T CD4 și progresia bolii, elemente ce trebuie luate în considerare la aplicarea tratamentului.
| HIV-1 ARN (CANTITATIV) | Preţ: 157 lei |
|---|
Promoţia este valabilă până la 31.12.2016, în toate centrele de recoltare Synevo din țară, atât pentru pacienţii cu trimitere de la medic, cât și fără trimitere de la medic. Este necesară prezentarea buletinului de identitate la înregistrarea în recepţie.
Pentru mai multe detalii despre HIV-1 ARN (CANTITATIV) click AICI.
Cariotipul din măduva osoasă
Pentru detectarea modificărilor cromozomiale asociate cu cancerele hematologice, sursa optimă de celule este măduva osoasă.
Cariotipul din măduva osoasă a devenit în ultimii ani una dintre metodele de elecție în identificarea unor boli hematologice maligne (leucemii, afecțiuni mieloproliferative și limfoproliferative, sindroame mielodisplazice).
CARIOTIPUL DIN MĂDUVA OSOASĂ

- stabilirea intrării în remisiune a bolii
- stabilirea prognosticului bolii
- diagnosticul altor afecțiuni hematologice (sindroame mieloproliferative, afecțiuni limfoproliferative, sindroame mielodisplazice)
- stabilirea terapiei pacienților cu leucemie
- diagnosticul leucemiilor
Dintre afecțiunile hematologice vizibile prin cariotipul din măduva osoasă cele mai frecvent întâlnite în populația generală sunt:
- leucemia mieloidă acută (LMA) (leucemie non-limfocitară acută/leucemie granulocitară acută)
- leucemia mieloidă cronică (LMC)
- sindromul mielodisplazic (SMD)
- leucemiile limfocitare acute (LLA) – cu celule B sau T
- leucemia limfocitară cronică (LLC)
- limfoame (Burkitt, Hodgkin, non-Hodgkin, s.a.)
Modificările cromozomiale observate în urma cariotipului în cazul acestor procese patologice sunt variate, multiple și interesează majoritatea cromozomilor umani: translocații, inversii, duplicații, trisomii, monosomii, deleții, izocromozomi, cromozomi inelari, ș.a.
LEUCEMIA MIELOIDĂ ACUTĂ (LMA)

LMA este caracterizată prin proliferarea anormală a mieloblastilor. Această afecțiune mai este denumită și leucemie mieloblastică acută, leucemie granulomatoasă acută sau leucemie non-limfocitară acută.
Cele mai frecvente modificări cromozomiale asociate acestei patologii sunt observate la nivelul cromozomilor umani 16, 3, 11, 22, 6, 8, 9, 5, 7 (genele ETO/RUNX1, AML1/RUNX1T1, KMT2A/MLL, CBFB, MYH1, MYH11, EV11, PML, RARA, ș.a)..
Detectarea anomaliilor cromozomiale la pacienții cu LMA permite selecția acestora și stabilirea unor grupe de risc în funcție de tipul modificării și cromozomul implicat. Translocațiile între cromozomii 8 și 21 – t(8;21) – și 15 și 17 – t(15;17) și inversiile la nivelul cromozomului 16 – inv(16) – sunt indicatoare ale unui prognostic semnificativ mai bun la persoanele cu LMA. Monosomiile totale sau parțiale ale cromozomilor 5 și 7 (7-, 5-, 7q-, 5q-), precum și modificări la nivelul brațului lung al cromozomului 3 – abn(3q) – sunt corelate evoluției negative a bolii precum și unei durate de viață mai scurte.
LEUCEMIA MIELOIDĂ CRONICĂ (LMC)

LMC a fost prima afecțiune malignă hematologică identificată a fi asociată cu anomalii cromozomiale. Din punct de vedere clinic, LMC este caracterizată prin proliferarea anormală a celulelor granulocitare ca urmare a transformării maligne a unor celule stem pluripotente.
Modificarea cromozomială observată la pacienții cu LMC este translocația reciprocă produsă între brațele lungi ale cromozomilor 9 și 22 – t(9;22)(q34;q11) – cu formarea cromozomului derivativ denumit cromozomul Philadelphia (Ph). Prezența Ph este definitorie pentru diagnosticul de LMC și pacienții cu simptomatologie LMC dar fără Ph ar trebui verificați pentru o altă modificare mieloproliferativă sau sindrom mielodisplazic.
Există variante ale translocației Ph (diferite alte puncte de ruptură sau locații cromozomiale), însă doar la un procent mic de cazuri (5-10%).
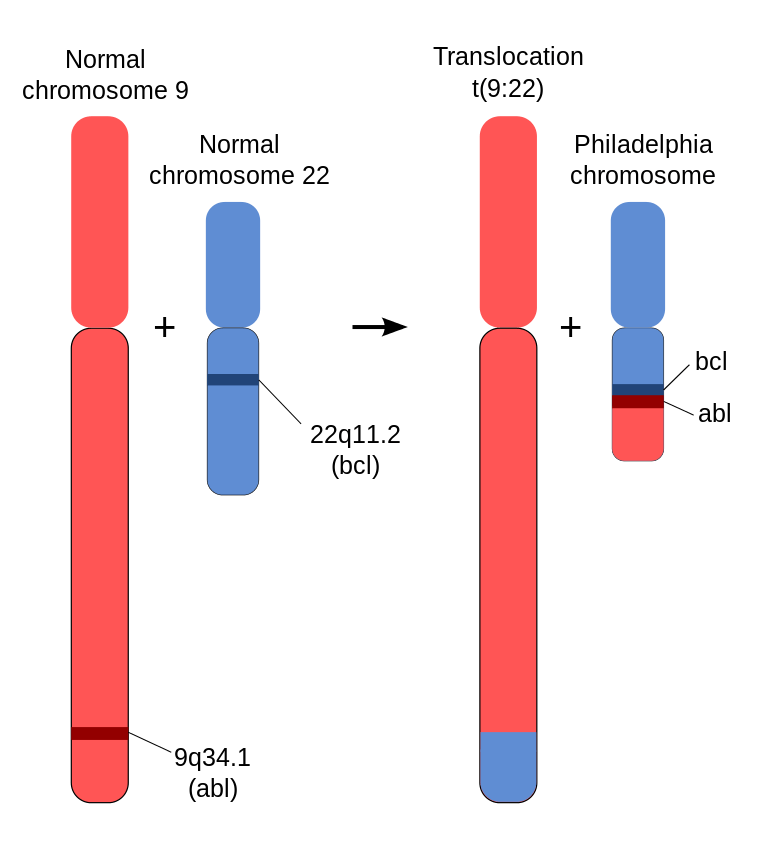
Translocație reciprocă (9;22) – cromozomul Philadelphia
SINDROMUL MIELODISPLAZIC (SMD)

SMD reprezintă un grup de afecțiuni la nivelul celulelor stem hepatopoietice caracterizate prin hematopoeza ineficientă și risc crescut de transformare în LMA.
Pentru confirmarea diagnosticului clinic de SMD, sunt importante analiza unui aspirat din măduva osoasă și analiza cromozomială din măduvă. Eventualele anomalii citogenetice reprezintă un indicator pentru riscul de dezvoltare a LMA.
Printre modificările cromozomiale observate la pacienții cu SMD, cele mai frecvente sunt monosomiile parțiale 5q, 7q, 20q (deleții 5q / 7q / 20q – lipsa brațului lung) sau prezența unor rearanjamente cromozomiale complexe (modificări la nivelul mai multor cromozomi).
LEUCEMIA LIMFOCITARĂ ACUTĂ (LLA)

Transformarea malignă a unor celule stem hematopoietice nediferențiate sau parțial diferențiată determină producerea LLA și LMA.
În cazul LLA, cel puțin 2/3 dintre pacienți prezintă modificări cromozomiale, în timp ce până la 90% dintre copiii diagnosticați evidențiază anomalii citogenetice.
Cele mai frecvente modificări cromozomiale observate la pacienții cu LLA sunt translocațiile reciproce între cromozomii 8 și 21 – t(8;21) – respectiv 15 și 17 – t(15;17) – precum și inversii la nivelul cromozomului 16 – inv(16). Alte anomalii citogenetice sunt monosomia parțială 5q – del(5q), deleții la nivelul brațului lung al cromozomului 9 – del(9p), precum și alte translocații reciproce – t(8;14), t(1;19) (gene de fuziune IGH/MYC, PBX/E2A-TCF3), ș.a.
Translocația t(9;22) (gena de fuziune BCR/ABL) este de asemenea una dintre modificările prezente la pacienții cu LLA.

Gene, locații cromozomiale și modificări genetice în LLA
LEUCEMIA LIMFOCITARĂ CRONICĂ (LLC)

LLC este cea mai frecventă formă de leucemie la populația caucaziană, cu simptomatologie variabilă, de la cazuri neutre până la variante severe și agresive de boală cu evoluție rapidă.
Cea mai frecvent întâlnită modificare genetică la pacienții cu LLC (peste 50% din cazuri) este deleția del(13q14) de la nivelul brațului lung al cromozomului 14, cu afectarea genei RB1.
Trisomia cromozomului 12 este de asemenea una dintre anomaliile genetice comune (10-20% din cazuri). De multe ori trisomia este singura modificare observată la pacienții cu LLC, însă deseori poate fi însoțită și de alte aberații cromozomiale (trisomii 18, 19, deleții 13q, 14q, 11q, 17p, translocații incluzând gena IGH, ș.a.).
Alte anomalii cromozomiale identificate la pacienții cu LLC sunt deleția parțială a brațului scurt al cromozomului 17 – del(17p), cu alterarea genei p53 – precum și translocații continuând gena IGH – t(11;14), t(14;19), gene de fuziune CCND1/IGH și respectiv BCL3/IGH. Inversii la nivelul brațului lung al cromozomului 14 – del(14q23.1) – sunt de asemenea considerate a fi implicate în LLC.
LIMFOAME

LIMFOMUL HODGKIN (LH)
LH este una dintre cele mai frecvente forme de cancer limfatic la nivel mondial, caracterizat printre altele prin hepatosplenomegalie, scădere bruscă în greutate, prurit, stare pre-febrilă, fatigabilitate, dureri lombare, transpirații nocturne, sindrom nefrotic, etc. Până la 50% dintre cazurile de LH sunt produse de virusul Epstein-Barr, existând și o formă imunodeficitară a afecțiunii la pacienții cu HIV/SIDA.
Din punct de vedere molecular există o serie de modificări genice care pot determina producerea LH, cum ar fi mutații la nivelul genelor membre ale căilor de semnalizare NF-KB și JAK/STAT (NFKB1A, NFKB1E, ANFAIP3, SOCS1, REL, JAK2, CD95, TP53.
Din punct de vedere citogenetic, anomaliile cromozomiale observate mai frecvent la pacienții cu LH au fost modificări structurale la nivelul cromozomilor 1 și 11, monosomii parțiale 6q și 7q – del(6q) / del(7q), duplicații la nivelul brațului lung al cromozomului 14 – dup(14q), precum și trisomii ale cromozomilor 3 sau 7. Translocații incluzând gena BCL3 (locație cromozomială 19q13.32), precum și modificări conținând regiunea 4q25-q28 au fost de asemenea, raportate la unii dintre pacienți.
LIMFOAME NON-HODGKIN (LNH)
Limfoamele non-Hodgkin reprezintă un grup de afecțiuni maligne produse de agenți infecțioși, factori de mediu, imunosupresie, inflamație cronică sau rearanjamente cromozomiale.
Anomaliile citogenetice cele mai frecvent întâlnite la pacienții cu LNH sunt modificări structurale care includ regiunea cromozomială 14q32 (gena IGH), cum sunt translocațiile reciproce t(14;18)(q32;q21) și t(8;14)(q24;q32), cu formarea genelor de fuziune BCL2/IGH, respectiv cMYC/IGH. Alte aberații cromozomiale raportate la acești pacienți sunt monosomia parțială 6q – del(6q), izocromozomul 17 – i(17q), trisomii ale cromozomilor 3, 7, 12, 18 sau 21, duplicații la nivelul brațelor scurte ale cromozomilor 2 și 3 – dup(2p), dup(3p), precum și modificări structurale la nivelul cromozomului 17 (ultimele fiind predictive pentru o evoluție agresivă a bolii).
LIMFOMUL BURKITT (LB)
LB este o formă de limfoame non-Hodgkin cu celule B care apare în special la copii și tineri. Dintre cele 3 tipuri de LB (sporadic, endemic și imunodeficitară), tipul sporadic este cel identificat la nivelul populației generale (cel endemic fiind determinat de virusul Epstein-Barr în special la populația africană și cel imunodeficitar fiind prezent la pacienții cu HIV/SIDA). LB este o afecțiune extrem de agresivă care poate afecta sistemul nervos central, măduva osoasă, mezenterul, vezica urinară, rinichii, ovarele și alte organe.
Modificarea citogenetică definitorie pentru LB (identificată în 60-70% dintre cazuri) este translocația reciprocă brațele lungi ale cromozomilor 8 și 14 – t(8;14)(q24;q32), cu formarea genei de fuziune IGH-cMYC – denumită și translocația Burkitt. Această aberație cromozomială este sinonimă cu o evoluție agresivă a afecțiunii.
Alte translocații reciproce care interesează regiunea cromozomială 8q24 (gena cMYC) – t(8;22)(q24;q11) și t(2;8)(p12;q24), gene de fuziune IGL/cMYC, respectiv (IGK/cMYC) – sunt considerații variate ale translocației Burkitt.
La un numar mic de cazuri au fost observate duplicații la nivelul brațului lung al cromozomului 1 (1q21-q25).

Modificări genetice observate la pacienții cu diferite tipuri de afecțiuni hematologoice maligne
PROCEDURA

Specimen recoltat: maduvă osoasă
Etichetarea recipientelor: se face cu etichetă albă, pe care este notat cel puțin barcode-ul.
Transportul probelor: Transportul se efectuează cu respectarea condițiilor de stabilitate a probei: la 20-250C maxim 24 ore din momentul recoltării probei până la intrarea acesteia în lucru.
Condiții de prelucrare și păstrare a probelor biologice până la examinare:
Omogenizarea probei după recoltare și păstrarea până la însămânțare: la 18-250C maxim 24 ore din momentul recoltării probei până la intrarea acesteia în lucru.
Volumul minim necesar: 3 ml maduvă osoasă.
Criterii de respingere a probei: recoltare pe vacutainer incorect; volum insuficient; probe recoltate mai mult de 3 zile; coagulate.
Pregătirea pacientului: pacientul să nu fi urmat tratament cu antibiotic sau să nu fi efectuat radiografii în luna anterioară recoltării.
Prelucrarea necesară după recoltare: omogenizarea probei. Proba se pune în lucru cât mai repede; dacă acest lucru nu este posibil, proba se stochează la 20-25°C maxim 24 de ore.
Recipient de recoltare: recipient cu heparină sodică.
ŞOFER PROFESIONIST: Braşov
Candidatul la postul de ŞOFER PROFESIONIST în cadrul Laboratorului SYNEVO BRAŞOV va avea permis de conducere categoria B (existenţa categoriei D reprezintă un avantaj), experienţă în domeniu de minim 3 ani, nu va avea antecedente penale şi va prezenta referinţe de la locurile de muncă anterioare.
Descrierea jobului
Angajăm şofer pentru transport persoane şi marfă, în Braşov şi în ţara.
Cancerul moştenit. Rolul genelor BRCA1 şi BRCA2
Sindromul cancerului ereditar de sân şi ovar reprezintă predispoziţia moştenită pentru cancerul de sân şi/sau ovar cauzată de mutaţii germinale patogene la nivelul genelor BRCA1 sau BRCA2. Este cea mai frecventă formă de cancer ereditar de sân şi/sau ovar şi se caracterizează printr-un risc crescut de cancer de sân şi de ovar. De asemenea, este cunoscută implicarea genelor BRCA1/BRCA2 în predispoziţia pentru alte tipuri de cancere precum cel de prostată, pancreatic, uterin, cervical, gastric, vezical, de duct biliar sau melanoame.
Această predispoziţie se identifică prin testarea genetică pentru mutaţii în genele BRCA1/BRCA2. Persoanele cu mutaţii patogene în aceste gene au un risc mai mare decât cel din populaţia generală de a dezvolta la un moment dat în viaţă un astfel de cancer.
În infograficul de mai jos poți găsi mai multe informații legate de moștenirea cancerului de sân și despre rolul mutațiilor BRCA1 și BRCA2.
| Mutaţii BRCA1 şi BRCA2 – cancer ereditar sân/ovar | Preţ: 3200 lei |
|---|
Profil trombofilie ereditara teste genetice
Intoleranța la histamină
CE ESTE
intoleranța la histamină?

 Prin intoleranța la histamină se înțelege un dezechilibru între histamina acumulata în organism şi capacitatea de degradare a acesteia. Cauza este deficitul de diaminooxidază (DAO), enzimă care intervine în metabolismul histaminei. Intoleranța la histamină se manifestă clinic în momentul în care în organism se găsește o cantitate de histamină, pe care acesta nu o poate degrada. De asemenea, există boli alergice, precum astmul sau rinita alergică, care constituie surse suplimentare de histamină, ce se pot adăuga la histamina absorbită în organism din alimentație.
Prin intoleranța la histamină se înțelege un dezechilibru între histamina acumulata în organism şi capacitatea de degradare a acesteia. Cauza este deficitul de diaminooxidază (DAO), enzimă care intervine în metabolismul histaminei. Intoleranța la histamină se manifestă clinic în momentul în care în organism se găsește o cantitate de histamină, pe care acesta nu o poate degrada. De asemenea, există boli alergice, precum astmul sau rinita alergică, care constituie surse suplimentare de histamină, ce se pot adăuga la histamina absorbită în organism din alimentație.
SIMPTOME

 Imediat după consumul unor alimente bogate în histamină sau la câteva ore după aceasta, apar simptome precum: rinoree (secreţii nazale apoase), eruptii cutanate (zone de culoare roșie ce produc “mâncărimi”), dureri de cap, tulburări digestive (diaree, dureri abdominale, flatulenta), tulburări de ritm (bătăi neregulate ale inimii).
Imediat după consumul unor alimente bogate în histamină sau la câteva ore după aceasta, apar simptome precum: rinoree (secreţii nazale apoase), eruptii cutanate (zone de culoare roșie ce produc “mâncărimi”), dureri de cap, tulburări digestive (diaree, dureri abdominale, flatulenta), tulburări de ritm (bătăi neregulate ale inimii).
HISTAMINA

 Histamina apare în alimente prin activitatea bacteriilor, mai ales în timpul proceselor de maturare. De aceea histamina se găsește în cantități mari în alimentele fermentate (brânzeturi sau varză murată). Cu cât crește mai mult perioada de depozitare a alimentelor, cu atât se intensifica procesele bacteriene prin care este produsă histamină. De aceea, se recomandă ca alimentele și mâncărurile să fie consumate cât mai proaspăt posibil. Din cauza stabilității sale la variații de temperatură, histamina nu poate fi distrusă nici prin congelare și nici prin fierbere, prajire sau coacere.
Histamina apare în alimente prin activitatea bacteriilor, mai ales în timpul proceselor de maturare. De aceea histamina se găsește în cantități mari în alimentele fermentate (brânzeturi sau varză murată). Cu cât crește mai mult perioada de depozitare a alimentelor, cu atât se intensifica procesele bacteriene prin care este produsă histamină. De aceea, se recomandă ca alimentele și mâncărurile să fie consumate cât mai proaspăt posibil. Din cauza stabilității sale la variații de temperatură, histamina nu poate fi distrusă nici prin congelare și nici prin fierbere, prajire sau coacere.

- carne sau pește proaspăt
- gălbenușul de ou, albușul de ou (gătit, nu crud)
- fructe proaspete (cu excepția căpșunilor)
- legume proaspete (cu excepția roșiilor)
- cereale
- lapte proaspăt pasteurizat

- alcool
- brânzeturi maturate
- mezeluri afumate (salam, cârnați, suncă afumată)
- năut
- soia
- nuci
- cacao (este inclusă și ciocolata)
- dulciuri sau snacks-uri cu aditivi și coloranți
- oțet
Eliberatori de histamină (alimente care stimulează producerea de histamină la nivelul intestinului subțire)
- majoritatea citricelor: kiwi, lămâie, ananas, prune etc.
- cacao
- nuci
- fasole și linte
- roșii
- germeni de grâu
-
aditivi alimentari: benzoat, sulfiți, nitriți, glutamat, coloranți alimentari
Blocanți de diaminooxidază
- alcool
- ceai negru
- băuturi energizante
- ceai verde
- ceai mate
*Pentru iaurt, conţinutul de histamină variază în funcţie de cultură bacteriană folosită.
Bibliografie:

Cancer Ereditar Sân/Ovar. Profil mutaţii BRCA1 şi BRCA2 3,200 lei.
Canceru l de sân reprezintă cea de-a doua cauză de deces prin cancer la femei. Statisticile spun că o femeie din 36 moare din cauza unui cancer de sân. 5-10% din toate cancerele de sân sunt reprezentate de cancerele ereditare iar dintre acestea 10% sunt cancere ereditare cauzate de mutații în genele BRCA, adică una din 10 persoane care au un cancer de sân ereditar au mutații patogene în genele BRCA.
l de sân reprezintă cea de-a doua cauză de deces prin cancer la femei. Statisticile spun că o femeie din 36 moare din cauza unui cancer de sân. 5-10% din toate cancerele de sân sunt reprezentate de cancerele ereditare iar dintre acestea 10% sunt cancere ereditare cauzate de mutații în genele BRCA, adică una din 10 persoane care au un cancer de sân ereditar au mutații patogene în genele BRCA.
Sindromul cancerului ereditar de sân şi ovar (HBOC – Hereditary Breast and Ovarian Cancer) reprezintă predispoziţia moştenită pentru cancerul de sân şi/sau ovar cauzată de mutaţii germinale patogene la nivelul genelor BRCA1 sau BRCA2 (BReast Cancer Associated).
Un rol foarte important în scăderea ratei de decese și prelungirea supraviețuirii îl are “conștientizarea”. Această predispoziţie se identifică prin testarea genetică pentru mutaţii în genele BRCA1/2, iar pacienţii identificaţi cu mutaţii patogene beneficiază de screening şi metode de prevenţie menite să reduca riscul de a dezvolta HBOC. Importanţa testării rezidă în faptul că managementul unui pacient cu cancer de sân/ovar care prezintă mutaţii patogene în genele BRCA1/BRCA2 se va modifica foarte mult comparativ cu cel practicat în cazul formelor sporadice.
Mai multe detalii medicale AICI
Citeşte pe scurt despre cancerul moştenit AICI
Cum să îţi pregăteşti copilul pentru recoltarea de analize

“Dacă nu ești cuminte, te duc la doctor să-ți facă injecție!”
– aceasta este amenințarea cea mai lipsită de inspirație, la care niciun adult responsabil nu ar trebui să apeleze vreodată. De ce? Pentru că se știe, frica de înțepături este oricum destul de frecventă, îndeosebi în rândul copiilor. Până la urmă, ca orice temere, și aceasta este o formă de apărare izvorâtă din instinctul de conservare. Toate fricile până la un punct se justifică și sunt perfect sănătoase și utile, în măsura în care se dovedesc necesare supraviețuirii. Intensitatea și formele de manifestare ale acestei frici (de doctor, de injecție) diferă și pot fi modelate. Lesne de înțeles, în zilele noastre când analizele sunt necesare cu o frecvență destul de mare, această frică nu-și are rostul. De aceea, indicat este să intervenim înainte ca emoția să capete proporții catastrofale și să ne scape de sub control. Dacă nu vorbim despre frici, nu înseamnă că nu există sau că dispar. Copiii au nevoie de ajutor pentru a scăpa de temeri și a-și dezvolta curajul de a le depăși. Înainte de a fi curajoși, simțim frica și evaluăm obiectiv pericolul. În lipsa acestei judecăți am fi doar nesăbuiți, nu-i așa?!
Când vine vorba de copii, părinții sunt cei cărora le revine sarcina de a-i pregăti corespunzator înainte de “proba acului” de la primele analize. O pregătire corectă va preveni crizele de opoziție și momentele explozive la care asistăm deseori în cabinetele medicale. Teama instinctivă și necunoașterea în detaliu a celor ce urmează să se întâmple declanșează uneori copiilor adevărate crize (așa zisele tantrum-uri). Vestea bună este că aceste episoade deranjante pentru cei din jur și traumatizante pentru copii pot fi evitate cu ușurință printr-o bună pregătire prealabilă.

Puterea exemplului funcționează mereu: vă puteți recolta o probă de sânge înainte și dovedind calm și stăpânire, cel mic va reuși să capete mai multă încredere în raport cu situația în sine. Însă acest demers demonstrativ de tipul “dacă eu pot, poți și tu” de cele mai multe ori nu este îndeajuns. Ar mai fi de adăugat doar câ teva ingrediente “magice” pentru ca succesul să fie (aproape) garantat.
Răspunsurile corecte și complete oferă o imagine realistă și setează așteptările:
DE CE TREBUIE SĂ NE ÎNȚEPE?

Povestește-i pe înțelesul lui despre necesitatea de a ne cunoaște starea de sănătate și ce șansă extraordinară avem de a beneficia de acele mașinării speciale care pot descifra mesajele înscrise în sângele nostru. O metaforă inspirată face cât o mie de cuvinte, așa putem face apel la o comparație care să-l apropie pe cel mic de pasiunile sale. Dacă este fetiță, vorbiți ca despre o zână sau o prințesă, dacă este băiat invocați un super-erou sau un robot cu puteri excepționale. De asemenea, înainte de a veni în centrul de recoltare, îi poţi citi Povestea fluturaşului Flu Flu, special creată pentru cel mic. Așa se vasimți mai familiar față de situație și va avea niște “ancore” pe care să se sprijine.
CÂT DUREAZĂ?

Înțepătura durează o clipă, dar mai trebuie să stăm liniștiți câteva minute, până cănd se scurge prin acul acela subțire o cantitate suficientă de sânge pentru analize. Tocmai pentru că acea înțepătură este foarte mică, procesul de recoltare durează ceva mai mult, dar tot de aceea se și vindecă repede și mica durere dispare odată ce iese acul. Ajută-l să înțeleagă că deși nu este plăcut, este foarte util și toți oamenii fac acest efort din când în când, pentru a-și monitoriza starea de sănătate.
O SĂ MĂ DOARĂ?

Da, înțepătura de la început nu este tocmai plăcută, dar este suportabilă și majoritatea oamenilor rezistă cu ușurință. Vă puteți ciupi în joacă pentru a simula senzația de înțepătură și a se familiariza copilul cu acest mic disconfort. Copiii își exprimă și reglează emoțiile cel mai ușor prin joc, așadar ar fi o idee minunată să vă folosiți imaginația și să inițiați un joc în care să simulați ceea ce știți că se va întâmpla în cabinet. Cei mici pot avea pe rând și rolul de pacient și cel de asistent sau medic. Apoi copilul poate repeta jocul cu jucăria preferată pe care o duce la analize, din dorința de a o știi sănătoasă și ca să se poată juca împreună cât mai mult timp. Există și truse medicale de jucărie pe care mulți copii ajung să le îndrăgească. Cine știe cum, prin această joacă faceți chiar un prim pas spre descoperirea vocației unui viitor medic…

Arătați-le copiilor că le înțelegeți sentimentele (punându-le toate neliniștile în cuvinte) și că le acceptați trăirile. Astfel vor ști că sunteți lângă ei și se vor simți în siguranță, devenind mai liniștiți și mai capabili să-și controleze manifestările fricii.
LAUDE ȘI APRECIERI LA FINAL – ÎNCURAJARE AUTOCONTROLULUI.

În final împărtășim o mare descoperire din știința psihologică: din punct de vedere al percepției subiective, momentele “cheie” ale oricărei întâmplări sunt începutul și finalul.
Pe scurt, o bună pregătire în trei pași ar începe cu povestea frumoasă a fluturaşului Flu Flu scrisă special pentru cei mici, ar continua cu încurajări pentru acceptarea micului disconfort al înțepăturii și, pentru ca totul să meargă strună, vom proiecta un “final glorios”. Chiar dacă recoltarea propriu-zisă se întâmplă să dureze ceva mai mult, cel mai important moment care va rămâne în amintirea celui mic este felul în care se încheie această experiență. Orice copil va fi plăcut impresionat să primească laude și aprecieri sincere pentru răbdarea și curajul de care a dat dovadă. Astfel va căpăta încredere că se poate controla și va observa cu mândrie că acest efort a adus mulțumire. Odată ce reușește să-și controleze temerile și să facă dovadă stăpânirii de sine, copilul va avea resurse de a face față cu bine și următoarei provocări!
Alessandra Mustăreaţă, psiholog
Noul centru de recoltare Bucureşti Dristor
Pe 21 noiembrie Synevo anunţă deschiderea celui de-al 68-lea centru de recoltare din România.
68-lea centru de recoltare din România.
Adresa: Şos. Mihai Bravu nr. 311/313, bl. SB 1, sector 3, Bucureşti
Tel: 021 9666
Program de lucru: L-V: 7.00 – 16.00
Program de recoltare: L-V: 7.00 – 14.00
Program recoltare probe ginecologice: L-V: 7.00 – 14.00
Mai multe detalii AICI.
Noul centru de recoltare Brașov 15 noiembrie
Synevo deschide cel de-al 69-lea centru de recoltare din România și cel de-al 3-lea din Brașov.
69-lea centru de recoltare din România și cel de-al 3-lea din Brașov.
Adresa: B-dul. 15 Noiembrie, nr. 43, Brașov
Tel: 0268 424 072
Program de lucru: L-V: 7.00 – 14.00
Program de recoltare: L-V: 7.00 – 13.30
Mai multe detalii AICI.
Contabil: Bucuresti
Candidatul ideal
- Studii superioare în domeniul economic (preferabil specializare Contabilitate de gestiune);
- 3 ani experiență în domeniu, cunoașterea avansată a unui soft de contabilitate (preferabil SunSystems sau Charisma Enterprise);
- Cunoașterea limbii engleze reprezintă un avantaj.
- Cunoașterea legislației în domeniu.
Descrierea jobului
- Înregistrarea facturilor de achiziții, în conformitate cu standardele de contabilitate și contractele încheiate;
- Întocmirea și analiza rapoartelor AP;
- Reconcilierea balanței de furnizori din modulul de AP cu balanța de verificare din modulul GL, Codul fiscal și a procedurilor interne;
- Rularea procedurii de inchidere a stocurilor și reconcilierea lunară a conturilor de stoc GL cu rapoartele de stoc;
- Înregistrarea facturilor de mijloace fixe și a obiectelor de inventar în modulul de fixet asset (inclusiv facturile de avans aferente, imobilizările în curs), emiterea și înregistrarea PV de casare a mijloacelor fixe, înregistrare amortizare lunară, reconcilieri între modulul de mijloace fixe și balanța de verificare din modulul GL.
- Evidența și înregistrarea contabilă a documentelor aferente achizițiilor de mărfuri și servicii;
- Verificare și înregistrare deconturi de cheltuieli și dispoziții plată / încasare;
- Efectuează punctaje /confirmări de solduri cu clienții și furnizorii societății;
- Verificarea corectitudinii registrelor de casă întocmite în locații (puncte de lucru);
- Postează facturile de achiziții de bunuri stocabile după verificarea prealabilă a concordanței dintre factură și NIR
- Generează din sistemul informatic și verifică corectitudinea fișierului de plăți;
- Îndosariază și arhivează documentele contabile;
- Evidența asigurărilor Casco și RCA;
Numai candidații considerați potriviți vor fi contactați.
Garantăm confidențialitatea informațiilor.
Program special 30 noiembrie – 01 decembrie
| PROGRAM SPECIAL 30 NOV – 01 DEC | |
| Oraş | Program |
| ARAD | ÎNCHIS |
| BACĂU | ÎNCHIS |
| BUCUREŞTI | Centrele de recoltare Grozovici, Plevna, Drumul Taberei, Olteniţei, Unirii: Program de lucru/recoltare: 08.00-12.00 Restul centrelor de recoltare: ÎNCHIS |
| BUZĂU | ÎNCHIS |
| BRAŞOV | ÎNCHIS |
| BRĂILA | ÎNCHIS |
| BOTOŞANI | ÎNCHIS |
| CÂMPULUNG MOLDOVENESC | ÎNCHIS |
| CÂMPIA TURZII | ÎNCHIS |
| CLUJ | ÎNCHIS |
| CONSTANŢA | Program de lucru/recoltare: 30.11.2016: 08.00-12.00 Program de lucru/recoltare: 01.12.2016: ÎNCHIS |
| CRAIOVA | Laborator: Program receptie/recoltare: 30.11.2016 – 08.00-16.00 Program receptie/recoltare: 01.12.2016 – 08.00-16.00 Centrul de recoltare Tabaci: ÎNCHIS |
| DEVA | ÎNCHIS |
| GALAŢI | ÎNCHIS |
| GURA HUMORULUI | ÎNCHIS |
| IAŞI | ÎNCHIS |
| MEDGIDIA | ÎNCHIS |
| MANGALIA | Program de lucru/recoltare: 30.11.2016: 08.00-12.00 Program de lucru/recoltare: 01.12.2016: ÎNCHIS |
| PLOIEŞTI | Centrul de recoltare Maiorescu: Program de lucru/recoltare: 08.00-12.00 Centrul de recoltare Malu Roşu: ÎNCHIS |
| PITEŞTI | Centrul de recoltare Teiuleanului: Program de lucru/recoltare: 08.00-12.00 Centrul de recoltare Victor Babeş: ÎNCHIS |
| RÂMNICU VÂLCEA | Program de lucru/recoltare: 07.00-11.00 |
| RĂDĂUŢI | ÎNCHIS |
| SATU-MARE | ÎNCHIS |
| SLATINA | ÎNCHIS |
| SUCEAVA | ÎNCHIS |
| SIBIU | ÎNCHIS |
| TÂRGOVIŞTE | ÎNCHIS |
| TIMIŞOARA | ÎNCHIS |
| VATRA DORNEI | ÎNCHIS |
Trichomonas vaginalis
Infecţiile genitale feminine reprezintă o cauză frecventă de consult ginecologic. Ele pot evolua ca infecţii endogene, determinate de microorganisme din flora vaginală normal sau infecţii exogene, cauzate în special de microorganisme cu transmitere sexuală precum bacterii (Neisseria gonorrhoeae, Chlamydia trachomatis – serotipurile D-K, Treponema pallidum), virusuri (Herpes simplex – tip 2, Papillomavirus) sau protozoare (Trichomonas vaginalis).
Imaginile prezentate au fost filmat în laboratorul Synevo România.
Mai multe detalii Aici.
Educația medicală continuă, o temă permanentă pentru Synevo
Temele medicale despre Histopatologie și Genetică au fost extrem de apreciate de către asistenții medicali, motiv pentru care am decis să mai organizăm încă un curs. În data de 15 noiembrie 2016 ni s-au alăturat peste 100 de cadre medicale medii din spitalele publice.
Pentru câteva ore, „Investigațiile histopatologice și genetice” au devenit subiectul de discuție, iar geneza acestor specialități medicale nu a mai avut niciun secret pentru cei aflați la workshop.
Temele științifice au fost susținute de către medicii de Laborator Synevo – Dr. Mihai Stoicea (Șef Departament Histopatologie), Dr. Viorica Rădoi (Șef Departament Genetică) și Dr. Antoanela Curici (Manager Laborator Central Synevo).
- Histopatologia – geneză, istoric și importanță practică
- Dr. Mihai Stoicea, Medic Primar Anatomie Patologică, Synevo România
- Genetica – geneză, istoric și importanță practică
- Dr. Viorica Rădoi, Medic Specialist Genetică Medicală, Synevo România
- IMD – ce sunt aceste probe, ce stabilitate au și care sunt particularitățile de transport
- Teste specializate de alergologie și imunologie
- Dr. Antoanela Curici, Medic Primar Medicină de Laborator, Synevo România
La finalul cursului, ca de fiecare dată, participanții au dat un test de evaluare a cunoștințelor medicale acumulate pe parcursul workshop-ului.
Cursul a fost creditat de către Ordinul Asistenților Medicali din București cu 8 credite EMC.
TE GÂNDEŞTI LA MASA DE SĂRBĂTORI?

Perioada sărbătorilor de iarnă este una de bucurie, petrecută alături de familie. Dar, din punct de vedere culinar, poate însemna o adevărată provocare, mai ales pentru persoanele care tind să considere că în aceste momente nu există limite și absolut totul le este permis, răsfăţându-se cu alimente grele, care surprind neplăcut organismul.
Un prim pas pentru a conştientiza urmările negative ale excesului de mâncare, precum și afecțiunile majore ce derivă din acesta, este să efectuezi testul “Profil lipidic”. Acest profil este alcătuit dintr-un grup de 5 teste, trigliceridele, lipidele totale, colesterolul LDL, colesterolul HDL și colesterolul total, ce au ca scop determinarea riscului de boală cardiovasculară. Evaluarea statusului lipidic, a tulburărilor metabolice, a riscului de ateroscleroză, stenoza coronariană și a infarctului miocardic este posibilă doar prin măsurarea nivelului de colesterol din sânge.
DACĂ VII ÎNTRE 05.12 – 05.01 ȘI PLĂTEȘTI TESTUL PROFIL LIPIDIC, ÎL POŢI REFACE ÎN MOD GRATUIT LUNA URMĂTOARE, 10.01 – 10.02, CA SĂ VEZI DACĂ ŢI-A CRESCUT COLESTEROLUL.
VA FI NEVOIE SĂ TE PREZINŢI CU FACTURA ȘI CUPONUL PRIMIT ÎN RECEPŢIE.
Promoţia este adresată pacienţilor care doresc să-şi verifice starea de sănătate în scop preventiv şi care nu au trimitere de la medic. Promoția nu se cumulează cu alte oferte.
Biomarkeri ai stresului oxidativ în sindromul metabolic
Sindromul metabolic reuneşte o constelație de factori fiziologici, biochimici, clinici și biologici interconectați ce identifică persoanele cu risc crescut de a dezvolta boli cardiovasculare şi diabet zaharat de tip 2. Astfel, prezenţa sindromului metabolic conferă un risc de trei ori mai mare de apariţie a bolii coronariene şi a accidentului vascular cerebral, dublând mortalitatea din aceste cauze. Riscul de moarte subită este de cinci ori mai mare la pacienţii cu diabet zaharat şi de 2-3 ori mai mare la pacienţii cu sindrom metabolic. Dacă diabetul zaharat nu este deja prezent, sindromul metabolic creşte de cinci ori riscul de apariţie a diabetului zaharat de tip 2.
Rezistența la insulină, obezitatea abdominală, dislipidemia aterogenă, disfuncția endotelială, valorile crescute ale tensiunii arteriale, starea de hipercoagulabilitate, predispoziția genetică și stresul cronic reprezintă principalii factori care stau la baza acestui sindrom.
Sindromul metabolic este caracterizat adesea prin stres oxidativ, condiție în care există un dezechilibru între producția și inactivarea speciilor reactive de oxigen. Generarea crescută de specii reactive de oxigen, scăderea activității sistemelor antioxidante sau ambele mecanisme pot fi implicate în apariția stresului oxidativ. Există numeroase date experimentale care susțin rolul potential al stresului oxidativ în producerea manifestărilor asociate sindromului metabolic, respectiv a aterosclerozei, hipertensiunii arteriale și a diabetului zaharat tip 2. În plus, pacienții cu sindrom metabolic prezintă pe de o parte o reducere a capacității antioxidante evidențiată prin niveluri serice scăzute de vitamină C, α-tocoferol și scăderea activității superoxid dismutazei, iar pe de altă parte o intensificare a peroxidării lipidelor ce are ca rezultat creșterea nivelurilor plasmatice de malondialdehidă, o creștere a grupărilor carbonil ca urmare a degradării oxidative a proteinelor, precum și o creștere a activității xantin-oxidazei ce conduce la o producție excesivă de radicali liberi.
Lipoproteinele cu densitate joasă oxidate (LDL oxidat) constituie un biomarker recunoscut al stresului oxidativ. LDL-oxidat activează monocitele circulante și crește capacitatea acestora de a infiltra peretele vascular, o etapă precoce în procesul de aterogeneză. Într-un studiu longitudinal s-a demonstrat că nivelurile plasmatice crescute de LDL oxidat au fost asociate cu un risc crescut de dezvoltare a sindromului metabolic. Pe de altă parte, au fost observate corelații între componentele sindromului metabolic și nivelurile de LDL oxidat circulant. Astfel, asocierea LDLoxidat cu obezitatea ar putea fi explicată prin creșterea masei de țesut adipos, ca rezultat al stimulării directe a proliferării adipocitelor, fie indirect prin creșterea infiltratului inflamator cu monocite/macrofage care favorizează la rândul său adipogeneza. Relația dintre LDL oxidat și hiperglicemie s-ar putea datora scăderii semnalizării insulinei prin receptorul său și a captării glucozei, precum și distrugerii celulelor β din insulele pancreatice. În ceea ce privește legătura dintre LDL oxidat și hipertrigliceridemie, aceasta ar avea la bază alterarea stocării trigliceridelor. La rândul său, sindromul metabolic exacerbează producerea de LDL oxidat printr-un mecanism de feed-back. Foarte important, concentrațiile plasmatice ridicate de LDL oxidat au fost asociate cu un risc crescut de infarct miocardic, independent de valorile LDL-colesterolului și a altor factori de risc cardiovasculari, ceea ce indică faptul că LDL-oxidat ar reprezenta un biomarker cu valoare predictivă. Aceste constatări au și consecințe terapeutice, însă sunt necesare investigații ulterioare pentru a demonstra rolul modificărilor de dietă și ale stilului de viață, precum și al tratamentul medicamentos care inhibă oxidarea LDL în prevenția sindromului metabolic. În laborator, LDL-oxidat se determină prin tehnici imunoenzimtice ce utilizează anticorpi monoclonali îndreptați împotriva epitopilor specifici oxidării de pe moleculele LDL.

Malondiladehida (MDA), un alt biomarker al stresului oxidativ, reprezintă produsul final al peroxidării lipidelor. Într-un studiu recent s-a arătat că adulții cu niveluri plasmatice crescute de MDA au prezentat o prevalență mai mare a sindromului metabolic, precum și valori mai mari ale circumferinței abdominale, glucozei, trigliceridelor și gama-glutamiltransferazei (GGT). În plus, nivelurile MDA s-au corelat direct cu ingestia de zaharoză. Cercetările viitoare vor analiza eficiența inhibitorilor de MDA în sindromul metabolic. În laborator, MDA se determină prin cromatografie de lichide sub înaltă presiune (HPLC).

Nitrotirozina (NT) este considerată un biomarker relativ specific pentru modificările oxidative mediate de peroxinitrit – un antioxidant potent ce induce nitrarea reziduurilor de tirozină din structura proteinelor. După ce anterior se arătase că NT reprezintă un factor de risc independent pentru afecțiunile cardiovasculare, un studiu a raportat o creștere progresivă a nivelurilor plasmatice de NT împreună cu valorile indicelui HOMA (“Homeostasis model assessment”) în funcție de numărul componentelor sindromului metabolic prezente la un pacient. 3-NT liberă în plasmă este determinate în laborator prin tehnica cromatografiei de lichide cuplată cu spectrometrie de masă (LC/MS).
Pentru evaluarea sistemului antioxidant ce are rolul a inactiva speciile rective de oxigen se poate recurge în practică la determinarea activității enzimelor glutation peroxidază (GPX) și superoxid dismutază (SOD). GPX, o enzimă ce conține seleniu, intervine în degradarea hidroperoxizilor organici rezultaţi din procesele metabolice normale şi asigură protecţia proteinelor, lipidelor şi acizilor nucleici faţă de acţiunea moleculelor oxidante. Conform unui grup de cercetători, activitatea GPX a fost semnificativ scăzută la pacienții cu sindrom metabolic, fiind asociată cu un stres oxidativ crescut și cu un status proinflamtor. În plus, s-a arătat că există o corelație inversă între activitatea GPX și indicele de masă corporală (BMI)/valoarea circumferinței abdominale. SOD este o familie de metaloenzime antioxidante care previne acumularea de anion superoxid ce poate reacționa la rândul său cu oxidul nitric și genera peroxinitrit. În sindromul metabolic s-a constatat că există o scădere a activității SOD, invers proporțională cu numărul componentelor sindromului metabolic prezente la pacient. În laborator se determină activitatea GPX și SOD în eritrocite prin metode fotometrice.
În concluzie, sindromul metabolic este o entitate clinică cu baze endocrine, metabolice și cardiovasculare complexe iar stresul oxidativ crescut este asociat cu componentele sindromului, fiind un considerat un eveniment precoce în patogenia acestora. Determinarea unor biomarkeri în sânge ar putea fi relevantă pe de o parte, în evaluarea gradului de stres oxidativ la pacienții care au un risc crescut sau prezintă deja sindrom metabolic, iar pe de altă parte în utilizarea de strategii terapeutice care vizează stresul oxidativ, cu scopul de a întârzia debutul sau împiedica progresia manifestărilor clinice.

Bibliografie:
1. Chen SJ et al. Relationships between Inflammation, Adiponectin, and Oxidative Stress in Metabolic Syndrome. PloS One. 2012,(9):e45693.
2. Esposito K et al. Oxidative stress in the metabolic syndrome. J Endocrinol Invest. 2006 Oct;29(9):791-5.
2. Isogawa A et al. Serum superoxide dismutase activity correlates with the components of metabolic syndrome or carotid artery intima-media thickness. Diabets Res Clin Pract. 2009;86(3):213-8.
4. Moreto L et al. The higher plasma malondialdehyde concentrations are determined by metabolic syndrome-related glucolipotoxicity. Oxid Med Cell Longev. 2014;2014:505368.
5. Roberts CK, Sindhu KK. Oxidative stress and metabolic syndrome. Life Sci. 2009 May 22;84(21-22):705-12.
6. Yuberro-Serrano EM et al. Oxidative stress is associated with the number of components of metabolic syndrome: LIPGENE study. See comment in PubMed Commons belowExp Mol Med. 2013 Jun 21;45:e28.
Particulele LDL „small-dense” (sdLDL) – factor de risc independent pentru ateroscleroză
Colesterolul LDL (Low-density lipoprotein cholesterol, LDL-C) este considerat a fi unul dintre cei mai importanți factori de risc pentru bolile cardiovasculare. Cu toate acestea, multe persoane cu nivel de LDL-C în intervalul de referință dezvoltă afecțiuni cardiovasculare1.
Lipoproteinele cu densitate joasă (LDL) sunt o populație heterogenă de particule lipidice ce variază în dimensiune, densitate, sarcină electrică și compoziție chimică (lipide și apoproteine). Heterogenitatea particulelor LDL a fost identificată pentru prima data în anii ’40 prin ultracentrifugare analitică și, mai târziu, prin ultracentrifugare în gradient de densitate și electroforeză în gel cu gradient. Aplicarea combinată a acestor tehnici a stabilit că în plasmă există mai multe subclase de LDL ce pot fi clasificate pe baza densității și dimensiunii particulelor în 3 fracțiuni majore, denumite LDL I-III (LDL-I cu intervalul de densitate: 1.022-1.032 Kg/L, LDL-II: 1.032-1.038 kg/L și LDL-III: 1.038-1.050 kg/L) și o fracțiune minoră, LDL-IV (1.050-1.063 kg/L). În plus, în funcție de predominanța unei anumite subclase LDL au fost definite următoarele fenotipuri: feniotipul A, în care predomină particulele LDL mari, ușoare (LDL-I și LDL-2, „large buoyant”, lbLDL), fenotipul B caracterizat prin predominanța particulelor LDL mici, dense (LDL-III, „small dense” LDL, sdLDL >50%) și un fenotip intermediar A/B (40-50% LDL-III)2.

Tipuri particule LDL – http://drjockers.com/11-steps-to-beat-heart-disease/
Dimensiunea particulelor LDL reprezintă un marker predictiv important pentru evenimentele cardiovasculare și progresia bolii coronariene iar predominanța particulelor sdLDL a fost acceptată de National Cholesterol Education Program Adult Treatment Panel III ca un factor de risc cardiovascular emergent3.
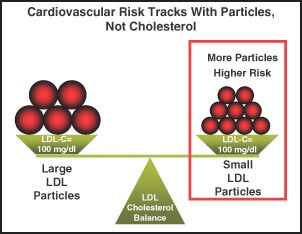
Dimensiunea si numarul particulelor LDL reprezintă un marker predictiv important pentru evenimentele cardiovasculare – http://www.onewellnessplace.com/blog/particlesize
Pentru a explica aterogenitatea crescută a sdLDL comparativ cu lbLDL au fost propuse o serie de mecanisme: o afinitate mai scăzută pentru receptorul LDL; un grad de penetrare mai mare în peretele arterial; interacțiune crescută cu componentele matricei extracelulare (retenție arterială crescută datorită legării la proteoglicani) și o mai mare sensibilitate la oxidare. Deoarece particulele sdLDL sunt mai mici și conțin mai puțin colesterol, nivelurile crescute de sdLDL reprezintă, de asemenea, un număr mai mare de particule aterogene, care nu pot să nu fie reflectate de nivelul de LDL-C1.
Distribuția subclaselor de LDL este determinată atât genetic cat și de factorii de mediu. Mai mult, concentrația de sdLDL este puternic corelată cu nivelul trigliceridelor și este crescută la persoanele cu diabet sau sindrom metabolic1.
Studii clinice recente au demonstrat că acumularea particulelor sdLDL în plasmă este asociată cu un risc crescut de boli cardiovasculare si sindrom metabolic. Mai mult, măsurarea concentrației colesterolului sdLDL (sdLDL-C) s-a dovedit a fi utilă în evaluarea prezenței și severității bolilor cardiovasculare. În plus, un studiu efectuat de Arai et al. a demonstrat utilitatea sdLDL-C ca marker predictiv pentru incidența afecțiunilor cardiace4.
De asemenea, prezența unor concentrații crescute de sdLDL este un predictor negativ în ceea ce privește evoluția pacienților cu angioplastie periferică. Prin urmare, măsurarea acestui parametru ar trebui luată în considerare la pacienții care vor suferi acest tip de intervenție. În plus, pentru a îmbunătăți rezultatele clinice după o astfel de intervenție vasculară trebuie aplicate terapiile de reducere a concentrației de sdLDL5.
În ceea privește patologia neurologică, un studiu recent a arătat că prezența sdLDL ar putea fi independent asociată cu un prognostic nefavorabil după un accident vascular ischemic acut6.
Recomandări pentru efectuarea testului:
- Hiperlipemie familială combinată
- Diabet zaharat tip II, rezistență la insulină, sindrom metabolic
- Sindromul ovarelor polichistice
- Hipertrigliceridemie postprandială marcată
- Pacienți dializați
- Boală renală cronică
- Pacienți cu profil lipidic clasic normal dar cu istoric familial pozitiv de afecțiuni cardiovasculare
- Monitorizarea terapiei hipolipemiante.
Condiții de recoltare, transport și stocare a probelor: este obligatoriu ca probele de sânge să fie recoltate à jeun (după 12 ore de la ultima masă) în vacutainer fără anticoagulant, cu/fără gel separator; serul obținut în urma centrifugării va fi transport și stocat la (-15)-(-25)°C până în momentul efectuării testului.
În laboratoarele Synevo sdLDL este determinat printr-o metodă fotometrică automată și este raportat la LDL-C total. Valorile procentuale < 35% sunt considerate fiziologice, în timp ce valorile > 50% sunt critice din punct de vedere fiziopatologic.
Nivelul de sdLDL poate fi redus prin dietă, activitate fizică7 și administrarea de statine8.
Referințe
- Hoogeveen RC1, Gaubatz JW, Sun W, Dodge RC, Crosby JR, Jiang J, Couper D, Virani SS, Kathiresan S, Boerwinkle E, Ballantyne CM. Small dense low-density lipoprotein-cholesterol concentrations predict risk for coronary heart disease: the Atherosclerosis Risk In Communities (ARIC) study. Arterioscler Thromb Vasc Biol. 2014 May;34(5):1069-77.
- Davies IG, Graham JM, Griffin BA. Rapid separation of LDL subclasses by iodixanol gradient ultracentrifugation. Clin Chem. 2003 Nov;49(11):1865-72.
- Rizzo M, Berneis K. Low-density lipoprotein size and cardiovascular risk assessment. QJM. 2006 Jan;99(1):1-4. 4. Cho Y, Lee SG, Jee SH, Kim JH. – Hypertriglyceridemia is a major factor associated with elevated levels of small dense LDL cholesterol in patients with metabolic syndrome. Ann Lab Med. 2015 Nov;35(6):586-94.
- Jacomella V, Gerber PA, Mosimann K, Husmann M, Thalhammer C, Wilkinson I, Berneis K, Amann-Vesti BR. Small dense low density lipoprotein particles are associated with poor outcome after angioplasty in peripheral artery disease. PLoS One. 2014 29;9(9):e108813.
- Manabe Y, Morihara R, Matsuzono K, Nakano Y, Takahashi Y, Narai H, Omori N, Abe K. Estimation of the Presence of Small Dense Lipoprotein Cholesterol in Acute Ischemic Stroke. Neurol Int. 2015 Jun 3;7(1):5973.
- Dutheil F, Walther G, Chapier R, Mnatzaganian G, Lesourd B, Naughton G, Verney J, Fogli A, Sapin V, Duclos M, Vinet A, Obert P, Courteix D, Lac G. Atherogenic subfractions of lipoproteins in the treatment of metabolic syndrome by physical activity and diet – the RESOLVE trial. Lipids Health Dis. 2014 Jul 11;13:112.
- Ai M, Otokozawa S, Asztalos BF, Nakajima K, Stein E, Jones PH, Schaefer EJ. Effects of maximal doses of atorvastatin versus rosuvastatin on small dense low-density lipoprotein cholesterol levels. Am J Cardiol. 2008 Feb 1;101(3):315-8.
Zilele Medicale Synevo 2016
A XIX-a ediţie a simpozionului interdisciplinar Zilele Medicale Synevo 2016 a reunit 1000 de lideri de opinie din domeniul medical, medici parteneri Synevo şi sponsori. Evenimentul a avut ca obiectiv reunirea specialiştilor implicaţi în managementul pacientului oncologic şi promovarea valorii de diagnostic a testelor de histopatologie şi oncogenetică, dar şi a specialiştilor implicaţi în monitorizarea sarcinii, evaluarea şi tratarea infertiliăţii, în vederea promovării testelor advance de ginecologie.
Evenimentul este recunoscut şi creditat de către Colegiul Medicilor din România cu 10 ore EMC.
Prima zi, 10 noiembrie, a fost dedicată specialităţii Obstetrică – Ginecologie
Sesiunea I – Screening, Diagnostic, Terapie și Etică în Medicina Fetală – a fost moderată de către Prof. Dr. Radu Vlădăreanu, care a prezentat un up-date al problemelelor de etică cu care se confruntă ginecologii care monitorizează sarcina.
Workshop-ul practic, interactiv de terapie fetală a fost moderat de către Conf. Dr. Claudiu Mărginean, Dr. Marius Calomfirescu şi Dr. Bogdan Mureşan.
Dr. Viorica Rădoi, şeful Departamentului de Genetică Synevo, a prezentat utilitatea consultului de genetică în identificarea malformaţiilor fetale.
În încheiere, Pof. Dr. Victoria Aramă a prezentat noutăţi în managementul herpesului la femeia gravidă.
Sesiunea a II a, de Medicină Reproductivă, moderată de către Prof. Dr. Mircea Onofriescu, a fost dedicată standardelor actuale de practică în infertilitate: diagnostic, prevenție si tratament.
Ca invitat special, Dr. Tina Buccholz, a prezentat rolul testatelor de genetică în diagnosticarea problemelor de infertilitate. Dr. Mădălin Margan a încheiat sesiunea cu o lucrare practică legată de rolul ecografiei în diagnosticarea endometriozei şi adenomiozei.
Sesiunea III – Managementul pacientei cu cancere ginecologice, a fost moderată de către Prof. Dr. Vlad Tica şi s-a axat pe etiologie, screening, diagnosticare şi tratament cancere de sân, col uterin şi ovare.
Dr. Mihai Stoicea şi Dr. Flaviu Crişan au prezentat două studii de caz din experienţa Departamentului de Histopatologie Synevo. Dr. Viorica Rădoi  şi Dr. Radu Ursu au prezentat două studii de caz din activitatea Departamentul de Genetică Synevo.
şi Dr. Radu Ursu au prezentat două studii de caz din activitatea Departamentul de Genetică Synevo.
Dr. Cătălin Haiduc şi Dr. Silviu Iştoc au prezentat un studiu de caz din cazuistica Departamentului de Ginecologie al Spitalului Medicover.
Dr. Mihai Ciochinar şi Dr. Delia Mateescu, medici în echipa Departmentului de Oncologie a Spitalului Medicover, au prezentat rolul terapiei sistemice în cancerul ovarian.
La finalul sesiunii, Prof. Dr. Mete Gungor, Spitalul Acibadem Turcia, a prezentat importanţa chirurgiei robotice în ginecologia oncologică.
În prima zi, audienţa a fost constituită din peste 400 medici specialişti şi primari în ginecologie, oncologie, chirurgie şi medicina internă.
A doua zi, 11 noiembrie, a fost dedicată Managementului pacientului oncologic cu cancere digestive şi pulmonare.
Sesiunea I, dedicată cancerelor digestive, a fost moderată de Prof. Adrian Miron.
Printre invitaţii grupului interdisciplinar, care a reunit medicii implicaţi în managementul acestor afecţiuni: gastroenterolog, chirurg, histopatolog, oncolog şi radioterapeut, amintim: Prof. Dr. Mihai Diculescu, Conf. Dr. Ioan Daniel, Sef Lucr. Dr. Valentin Calu, Conf. Doina Piciu, Dr. Cornelia Nitipir, Dr. Andrei Brinzeu şi Dr. Mircea Savu.
Dr. Mihai Stoicea şi Dr. An a Maria Jakob au prezentat studii de caz din experienţa Departamentului de Histopatologie Synevo. Dr. Violeta Cristea a subliniat rolul Departamentului de Microbiologie Synevo în diagnosticarea bolilor tractului digestiv.
a Maria Jakob au prezentat studii de caz din experienţa Departamentului de Histopatologie Synevo. Dr. Violeta Cristea a subliniat rolul Departamentului de Microbiologie Synevo în diagnosticarea bolilor tractului digestiv.
Ca invitaţi speciali amintim: Prof. Dr. Rafael Molina a prezentat importanţa markerilor tumorali în diagnosticarea şi monitorizarea evoluţiei tumorilor.
Sesiunea II – Managemenetul pacientului cu tumori pulmonare, moderată de către Prof. Dr. Miron Bogdan, a reunit specialiştii care fac parte din tumour boardul Spitalului Marius Nasta: pneumolog, histopatolog, chirurg, oncolog, radioterapeut.
Prof. Vesna Cemerikic Martinovic, Dr. Mihai Stoicea, Dr. Constantin Busuioc şi Dr. Alina Grigore au prezentat studii de caz din experienţa departamentelor de histopatologie Synevo din Serbia şi România.
Invitaţi speciali: Dr. Izidor Kern a prezentat importanţa testării EGFR din ţesut şi biopsia lichidă în dagnosticarea şi monitorizarea evoluţiei tumorii. Prof. Semih Halezeroglu, Spitalul Acibadem Turcia, a prezentat beneficiile Lobectomiei pulmonare VATS (video assisted toracic surgery) single port.
În ziua de varia, audienţa a fost constituită din peste 400 medici specialişti şi primari în gastroenterologie, chirurgie generală, oncologi şi endocrinologie.
La sfârşitul fiecărei sesiuni s-a organizat o tombolă în urma căreia medicii participanţi au câştigat premii: 14 cărţi de specialitate de la Editura Prior Books şi câte un cadou din partea Sensiblu, cel mai mare lanţ de farmacii din România, partener Synevo.












